
Die Kraft der Stammzellen für die moderne Biomedizin nutzbar machen

Gemeinsam mit dem wissenschaftlichen Mitarbeiter Marcel Gorka (l.) und der Studentin Irina Krützner (r.) hat sich Dr. Christian Hiepen (m.) auf den Weg an das Universitätsklinikum Gießen und Marburg gemacht, um biologisches Probenmaterial von Patient:innen mit seltenen, genetisch bedingten Erkrankungen an die WH in Recklinghausen zu überführen. © WH / S. Niewrzoll
Unsere Gesellschaft wird dank moderner Medizin immer älter. Damit einher geht allerdings auch eine Zunahme altersbedingter Erkrankungen wie beispielweise Krebs, Herz-Kreislauf-Erkrankungen, Diabetes oder Alzheimer. Um die Gesundheit der alternden Gesellschaft zu erhalten und neue Behandlungsoptionen zu entwickeln, forscht ein Team um Dr. Christian Hiepen – Vertretungsprofessor am Fachbereich Ingenieur- und Naturwissenschaften der Westfälischen Hochschule (WH) und Wissenschaftler am Fraunhofer Institut für Biomedizinische Technik – an neuen präventiven und individualisierten Behandlungsmethoden. Eine zentrale Rolle bei diesem Forschungsvorhaben spielen das Bioengineering und die Technologie der sogenannten induzierbaren pluripotenten Stammzellen (iPSC).
Wann und wie schnell sich Krankheiten entwickeln, wird oft durch komplexe Faktoren – wie etwa das Zusammenspiel von Genetik und persönlicher Lebensweise – bestimmt, weshalb präventive Maßnahmen oder effektive Therapien zunehmend individuell auf die Patient:innen zugeschnitten sein müssen. Um beispielsweise die Entstehung von Erkrankungen oder die optimalen Wirkstoffe im Laborversuch zu ermitteln, wird lebendes biologisches Material einzelner Patient:innen benötigt, welches durch modernste Verfahren beobachtet und analysiert werden kann. Menschliche Zellen im Labor so anzuzüchten, dass diese sich fast so verhalten, als würden sie im menschlichen Körper wachsen und so möglichst realistische Messdaten erzeugen, ist Ziel des sogenannten „zellulären Bioengineerings“. Prinzipien der Ingenieur- und Naturwissenschaften werden dabei auf Gewebe, Zellen und deren Moleküle angewendet. Die Zellen werden dabei nicht einfach in einer Petrischale kultiviert, sondern in technischen Vorrichtungen, die beispielsweise Blutfluss oder mechanische Belastung wie Strecken oder Dehnen simulieren. Neuste Erkenntnisse zeigen, dass diese physikalischen Reize mehr Einfluss auf die Krankheitsentstehung nehmen als bisher angenommen. Die komplexen Zellsysteme helfen darüber hinaus die Arbeit in der Forschung mit Versuchstieren zu reduzieren und teils ganz zu vermeiden. Sowohl ethisch als auch gesellschaftlich ist die Reduzierung von Tierversuchen aktuell geboten. Mit komplexen Zellmodellen ist auch eine Simulation komplizierter und individueller Krankheitsabläufe beim Menschen möglich. Bioengineering kann mit der Technologie der sogenannten induzierbaren pluripotenten Stammzellen (iPSC) kombiniert werden. Bei dieser – von den Medizinnobelpreisträgern Shinya Yamanaka und Sir John Gurdon 2012 entwickelten – Technologie kann aus der kleinsten Zellspende eines erwachsenen Menschen, beispielsweise einer Haut- oder Blutprobe, eine unbegrenzte Menge an Stammzellen im Labor reprogrammiert und gezüchtet werden. Durch iPSCs kann auf die Forschung mit menschlichen embryonalen Stammzellen verzichtet werden. Sie sind daher auch unter ethischen Aspekten aus der modernen Pharmaforschung nicht mehr wegzudenken. iPSCs verhalten sich wie embryonale Stammzellen. Aus einer kleinen Blutspende eines Alzheimerpatienten werden durch Reprogrammierung im Labor so beispielsweise Nervenzellen gezüchtet, die nicht nur dabei helfen, die jeweiligen Krankheitsmechanismen besser zu verstehen, sondern auch neue Medikamente oder maßgeschneiderte Therapiemöglichkeiten zu entwickeln. Das Erlernen der iPSC-Technologie und das praxisorientierte Bioengineering gehören seit kurzem zur praktischen und theoretischen Ausbildung in der Lehreinheit „Molekulare Biologie“ am Standort Recklinghausen. Um das dafür benötigte Zellmaterial bereitzustellen, hat sich die Recklinghäuser Forschungsgruppe um Dr. Christian Hiepen im April nach Marburg begeben und den Transport von iPSCs zur Erforschung von seltenen, genetisch bedingten Gefäßerkrankungen nach Recklinghausen begleitet. Der Transfer fand im Rahmen eines Treffens mit der Arbeitsgruppe des Kooperationspartners Prof. Dr. med. Robert Mandic, Oberarzt und Leiter des HNO Forschungslabors am Universitätsklinikum Gießen und Marburg (UKGM), statt. Neben dem Kennenlernen, verschiedenen Vorträgen und dem wissenschaftlichen Austausch beider Arbeitsgruppen, mit dem Ziel einer langfristigen Kollaboration, standen auch gemeinsame Projektideen und Strategien zur Drittmitteleinwerbung im Fokus. Zudem war auch eine Laborführung Teil des Programms, bei der die Forschenden die Gewebekultur und analytischen Verfahren in Marburg kennenlernten. Außerdem wurde besprochen, auf welche Besonderheiten beim Transport des biologischen Probenmaterials nach Recklinghausen zu achten sind.





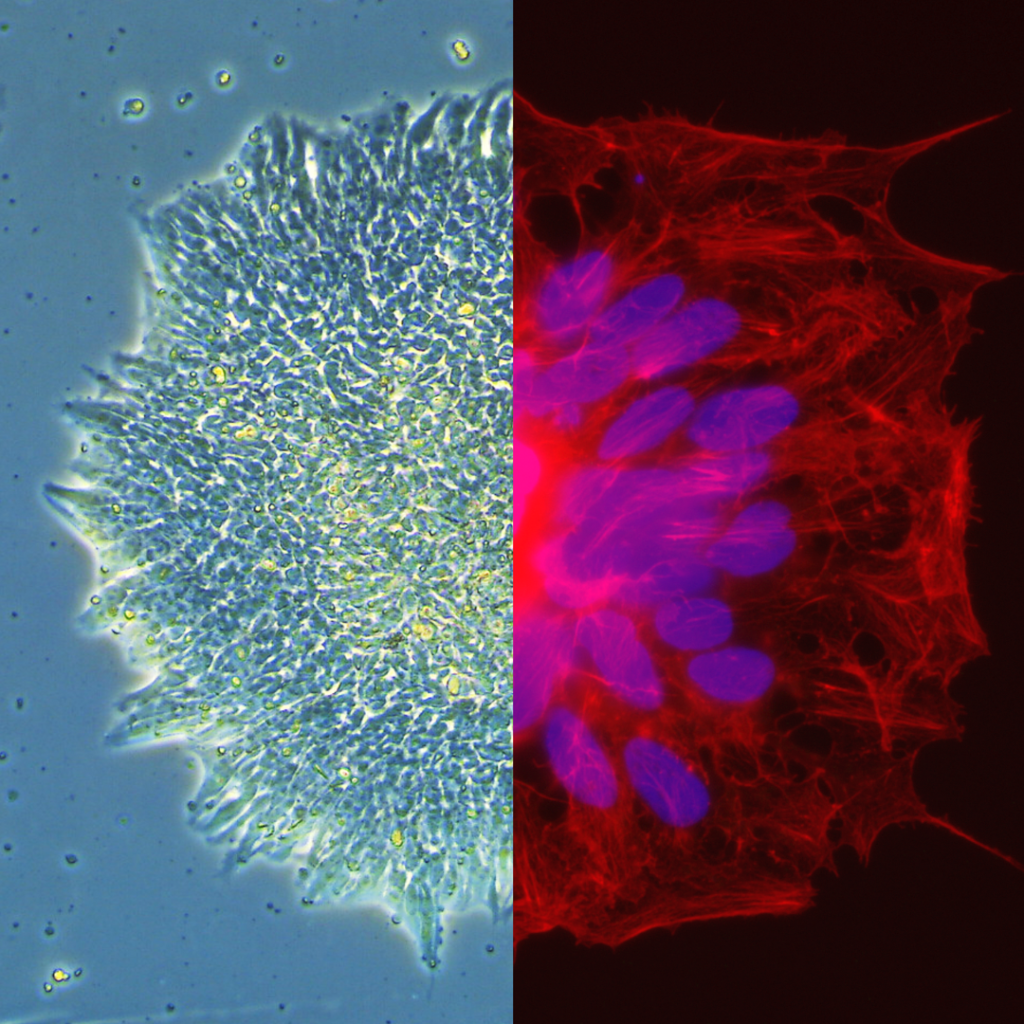
Stammzellenforschung am Campus Recklinghausen
Die überführten Stammzellen kommen nun am Fachbereich Ingenieur- und Naturwissenschaften im Labor für Biochemie und molekulare Zellbiologie zum Einsatz. Im aktuellen Forschungsvorhaben wird eine erblich bedingte Erkrankung des Blutgefäßsystems – die auch als „Morbus-Osler“ bekannte hereditäre hämorrhagische Teleangiektasie (HHT) – mit Hilfe der iPSC-Technologie und dem Bioengineering erforscht. Bei der HHT bilden sich Kurzschlussverbindungen zwischen arteriellen und venösen Blutgefäßen, die leicht aufreißen und zunächst als harmloses Nasenbluten oder kleinere Einblutungen in der Unterhaut im Gesichtsbereich und der Schleimhäute erscheinen. Im späteren Verlauf kann die HHT allerdings zu lebensbedrohlichen Gefäßveränderungen der Leber, Lunge oder des zentralen Nervensystems führen. Diese Erkrankung zu verstehen, neue Wirkstoffe zu entwickeln und Lehren aus der HHT zu ziehen, die eventuell für andere, häufiger verbreitete Gefäßerkrankungen wichtig sind, sind Ziele der gemeinsamen Arbeit mit dem Marburger Professor Dr. Robert Mandic. Das Recklinghäuser-Marburger Team nutzt dabei menschliche pluripotente Stammzellen mit Mutationen, die beim Menschen HHT auslösen. Anschließend wird im Labor versucht, durch Bioengineering daraus künstliche Gefäße nachzubauen, um dem Mechanismus der Gefäßfehlbildung auf mikroskopischer Ebene auf die Spur zu kommen. Die Forschenden wollen langfristig ein deutsches Forschungskonsortium etablieren, das sich dem Thema HHT und verwandten erblich bedingten Gefäßerkrankungen widmet.
Neben der weiteren Forschung der HHT nutzen Christian Hiepen und sein Team die iPSC-Technologie auch, um künstliche Gefäße für die Erforschung neuartiger Gefäßstents zu entwickeln. Immer mehr Menschen benötigen im Alter künstliche Stützstrukturen, um verschlossene oder gealterte Blutgefäße durchgängig zu halten. Zusammen mit dem Physikochemiker Michael Veith – ebenfalls Professor am Recklinghäuser Fachbereich Ingenieur- und Naturwissenschaften – und seinem Team entwickeln die Forschenden Stent-Beschichtungen, die nach dem Einsetzen eine bessere Verträglichkeit im menschlichen Körper aufweisen. Frisch implantierte Gefäßstents aus Metall wachsen nach dem Einsetzen beispielsweise in Herzkranzgefäßen besonders häufig wieder zu, sodass sie das Blutgefäß wieder verstopfen und entfernt werden müssen. „Dabei entsteht eine Art von Narbenbildung nach der Implantation, die sogenannte In-Stent Restenose“, weiß Dr. Hiepen. „Durch jahrelange vorrangegangene Forschungen haben wir eine neuartige Strategie entwickelt, wie diese Restenose von Stents verhindert werden soll“, ergänzt der Biochemiker.
Ein drittes Stammzellen-Projekt zielt auf die Analytik von Submikroplastik, also Plastikpartikeln unterhalb der mikrometer-Größe, ab und ist eine Kooperation des Zellbiologen Hiepen mit dem WH-Chemiker Prof. Ingo Tausendfreund. Dieser geht der Frage nach, wie man Submikroplastik, welches beispielsweise in Umweltproben zu finden ist, charakterisieren und mengenmäßig durch innovative Messverfahren erfassen kann. Bis heute ist weitestgehend unklar, welche eventuell toxischen Auswirkungen Mikroplastik auf den menschlichen Darmtrakt hat. Insbesondere scheint es bei der Zellschädigung beispielsweise von Darmzellen durch Submikroplastik auf die Art, Menge und Größe des Mikroplastiks anzukommen, sowie ob das Submikroplastik längere Zeit in der freien Umwelt lagerte und dabei eventuell weitere Giftstoffe an seine Oberfläche angezogen hat. Allerdings sind die bisher verwendeten Zellen und Tierversuche im Labor häufig nicht mit Zellen und ihrem Verhalten im menschlichen Darm vergleichbar. Ziel ist es nun in Recklinghausen mit Hilfe der iPSC-Technologie sogenannte Darm- Organoide aus menschlichen Zellen im Labor zu züchten, also „Mini-Därme“ von etwa der Größe eines Stecknadelkopfes, um tierversuchsfrei den Aufnahmemechanismus und die Toxizität von Submikroplastik zu analysieren. „Solche dreidimensionalen Tierversuchsersatzsysteme aus menschlichen Zellen werden in der Forschung und in der Entwicklung neuer Medikamente immer wichtiger und werden langfristig viele Tierversuche komplett überflüssig machen“, so Dr. Hiepen. Die Forschenden haben so schon herausgefunden, dass menschliche Darmzellen kleine antennenartige Fortsätze nutzen, sogenannte „Filopodien“, um mit den Mikroplastikpartikeln zu interagieren und diese in sich aufzunehmen. Dieser Prozess kann mit dem Mikroskop in Echtzeit beobachtet werden, um wichtige Erkenntnisse über den Aufnahmemechanismus und die zellschädigenden Einflüsse von Mikroplastik zu erlangen. Langfristiges Ziel ist es hier, den Aufnahmemechanismus von Mikroplastikpartikeln durch Darmzellen besser zu verstehen und zu unterscheiden, welche Plastikarten, Größen und Strukturen besser oder schlechter aufgenommen werden und so den menschlichen Darm schädigen. Die Recklinghäuser Wissenschaftler arbeiten dabei auch mit dem Bundesinstitut für Risikobewertung (BfR) in Berlin zusammen, eine Bundesbehörde, die bei der Einschätzung des Gefahrenpotentials von Mikroplastikpartikeln neue Standards setzt.
